Wie die Fotosynthese wirklich funktioniert
Neue Erkenntnisse über die Sauerstoffproduktion und den
Energietransfer in Pflanzen
 |
Die Fotosynthese ist Grundlage
für das Leben. Pflanzen wandeln Kohlendioxid und Wasser
mit Hilfe des Sonnenlichts um in Sauerstoff und Glucose, die
Grundlage der Nahrungspyramide. Dabei laufen sehr komplexe biochemische
Prozesse ab.
Foto: TU-Pressestelle |
Im Dezember 2005 haben TU-Wissenschaftler gemeinsam mit Projektpartnern
aus der FU des Sonderforschungsbereiches (SFB
498) neue Erkenntnisse zur Fotosynthese veröffentlicht.
Im Fachblatt Nature Vol. 438/15. Dezember 2005 (1040-1044) präsentierten
sie die Struktur des für die Sauerstoffentwicklung zuständigen
Fotosystems II in einer nie da gewesenen Auflösung (3,0 Ångström).
Diese gewährt neue Einblicke in den Elektronen- und Energietransfer
im Reaktionszentrum und in den Antenneneinheiten, die das Licht
sammeln. Wie es zu diesem Ergebnis kam und was die neuen Strukturdaten
bedeuten, erläutern Dr. Athina Zouni, die Leiterin der TU-Arbeitsgruppe
vom Max-Volmer-Laboratorium
für Biophysikalische Chemie, und Dr. Jan Kern, ihr engster
Mitarbeiter, im Interview.
Um mal ins Detail zu gehen - was genau sind die neuen Erkenntnisse,
die Sie zum Fotosystem II erschlossen haben?
Jan Kern: Das Wichtigste ist die komplette Übersicht,
die wir jetzt über die Cofaktoren haben. Die Proteinstruktur
an sich hatte man auch schon bei schlechteren Auflösungen gesehen,
aber die genaue Anordnung der Cofaktoren war nicht bekannt, also
das Auffüllen der Lücken zwischen den Proteinuntereinheiten.
Warum sind die Cofaktoren so wichtig und um was für Stoffe
handelt es sich?
Jan Kern: Sie steuern die wesentlichen Prozesse des Fotosystems,
sowohl das Sammeln von Licht als auch den Elektronentransfer und
die Wasserspaltung. Es sind Lipide, Carotinoide, Chlorophylle, Hämgruppen
und Metallionen. Erst wenn man deren Anordnung kennt, kann man verstehen,
nach welchem Mechanismus das Fotosystem arbeitet.
Können Sie ein oder zwei Beispiele für Cofaktoren
und deren Bedeutung nennen?
Jan Kern: Wir haben einerseits einige neue Carotinoide entdeckt
und andererseits haben wir durch das Füllen fast aller Lücken
bemerkt, dass ein Bereich offen geblieben ist, in dem kein Cofaktor
sitzt. Dies führte uns zu der Erkenntnis, dass an dieser Stelle
ein Kanal entsteht für einen mobilen Cofaktor, ein Chinon.
Dieses ist beweglich und diffundiert von der Membran ins Fotosystem
hinein. Dort nimmt es Elektronen auf und diffundiert zurück
in die Membran. Diesen Kanal hat vorher noch niemand gesehen, deshalb
ist dieses Ergebnis auch besonders spektakulär.
Athina Zouni: Ein anderes Beispiel sind die Lipide. Diese
hatte man bislang gar nicht als Cofaktoren angesehen. Erst in den
letzten zwei bis drei Jahren ist entdeckt worden, auch an anderen
Proteinstrukturen, dass sie eine so wichtige Rolle in Membranproteinen
spielen. Hier im Fotosystem II sind nun besonders viele Lipidmoleküle
vorhanden. Wir vermuten, dass sie wesentlich zur Flexibilität
des Systems beitragen, denn es gibt eine zentrale Untereinheit,
die besonders häufig auf- und abgebaut wird. Und diese Untereinheit
enthält besonders viele Lipide.
 |
Athina Zouni und Jan Kern
vom Max-Volmer-Laboratorium
Foto: TU-Pressestelle |
Die Fotosynthese ist ein Prozess, den man in der Schule lernt.
Sie gilt als gut untersuchtes System. Wann ist Ihnen zum ersten
Mal klar geworden, dass sie ein interessantes Forschungsobjekt ist,
an dem man noch viel machen kann?
Athina Zouni: Als ich mich 1995 an der Technischen Universität
Berlin beworben habe. Ich habe ein paar Artikel gelesen und fand
das Thema unglaublich spannend. Mir war gar nicht bewusst, dass
der Mechanismus, der hinter der einfachen Formel steckt (Wasser
plus Kohlendioxid und Lichtenergie ergibt Sauerstoff und Glucose),
nicht geklärt ist, dass es so viele offene Fragestellungen
gibt. Ich habe das Thema daraufhin als große Herausforderung
betrachtet. Besonders günstig waren die Voraussetzungen hier
an der TU, da bereits Dr. Fromme (Prof. H. T. Witt als Projektleiter)
am Fotosystem I arbeitete.
Wie sind Sie vorgegangen, was waren die ersten Aufgaben?
Athina Zouni: Wir haben zunächst Cyanobakterien gezüchtet
und anschließend das Fotosyntheseprotein aus der Membran herausgelöst.
Bis wir es kristallisieren und Strukturuntersuchungen durchführen
konnten, sind Jahre vergangen. Die Schritte der Reinigung, Isolierung
und begleitende Analysen waren fundamentale Arbeiten, die wir hier
an der TU durchgeführt haben. Die Kristallographie, also die
Auswertung der Daten aus der Röntgenstrukturanalyse, haben
dann unsere Kooperationspartner an der FU gemacht.
Wie drückt sich die jetzt erreichte Auflösung aus,
in der die Struktur nun dargestellt werden kann?
Jan Kern: Man kann sich das so vorstellen, dass ein Raster
über die Molekülstruktur gelegt wird. Je dichter die Punkte
sind, umso genauer sieht man die Feinheiten des Moleküls.
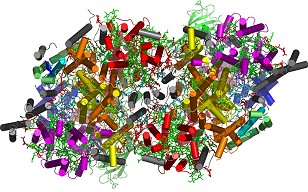 |
Das Fotosystem II ist einer
der beiden Proteinkomplexe, in denen die Lichtreaktionen der
Fotosynthese in Pflanzen stattfinden. Es ist zuständig
für die Entwicklung des Sauerstoffs – im Bild unten
die Struktur des dimeren Fotosystems II bei einer Auflösung
von 3.0 Ångström, das entspricht ungefähr einer
Breite von einem 10-millionstel Millimeter. Erstmalig erlaubt
diese Struktur detaillierte Einblicke in die Funktionsweise
des Sauerstoff entwickelnden Proteinkomplexes. Die Struktur
setzt sich aus vielen Mosaiksteinchen in Form von Proteinen
zusammen. Diese Protein-Untereinheiten sind in verschiedenen
Farben dargestellt. Jede Einheit hat ihre Aufgabe, etwa das
Sammeln des Lichtes oder die Wasserspaltung. Nur im Zusammenspiel
dieser Einheiten funktioniert die Fotosynthese.
Foto: Max-Volmer-Laboratorium |
Können Sie rekapitulieren, wann Sie das erste Mal ein richtiges
Aha-Erlebnis hatten?
Athina Zouni: Ja, als ich die ersten dunkelgrünen Kristalle
(1997) unter dem Mikroskop sah. Diese hatten damals eine Auflösung
von elf Ångström, welch eine Sensation. Außerdem
haben wir im Frühjahr 2000 erstmals die Elektronendichte im
Molekülsystem gesichtet. Das Strukturbild von Fotosystem II
mit der Auflösung von damals 3,8 Ångström war ein
großes und aufregendes Erlebnis und stellte einen entscheidenden
Durchbruch in der Fotosyntheseforschung dar (Publikation in Nature
2001, Zouni et al.).
Jan Kern: Mit dem jetzigen Bild bei 3 Ångström
konnten wir nun unmittelbar sehen, wie sich die Lücken schließen
und nach und nach die Cofaktoren, also Lipide, Carotinoide usw.
sichtbar werden. Das war großartig.
Von 1995, dem Beginn der Arbeit, bis 2000, als Sie das erste
Bild sahen, ist ein langer Zeitraum. Gab es während dieser
Zeit Einbahnstraßen, die sich als nicht gangbar herausgestellt
haben?
Athina Zouni: Es gab nicht nur Einbahnstraßen, sondern
auch Momente, in denen die Verzweiflung überhand nahm und ein
Abbruch der Arbeit vorstellbar wurde. Mit den Frustrationen umzugehen
lernt man nur mit der Zeit.
Woher haben Sie in solchen Phasen den Optimismus genommen, dass
es weitergeht?
Athina Zouni: Aus der Faszination, die das Thema bietet,
und dem Wissen, Neuland zu betreten, wobei wir uns gegenseitig motivieren.
Jan Kern: Wichtig ist auch die konstruktive und interessante
Zusammenarbeit mit den Kristallographen der FU. Beide Gruppen sind
ein eingeschworenes Team, fast schon untrennbar voneinander zu sehen.
Insgesamt lässt sich sagen, dass ohne die Kooperation im gesamten
SFB 498 derartige außergewöhnliche Ergebnisse nicht zustande
gekommen wären.
Ist das Forschungsprojekt jetzt beendet?
Athina Zouni: Die Auflösungsschärfe von 3 Ångström
war schon eine ziemliche Schallmauer, aber mindestens 2,8 Ångström
wollen wir noch erreichen. In diesem Bereich etwa liegen die Bindungsabstände
in dem Mangancluster, die wir jetzt noch nicht sehen. Unser SFB
wurde noch mal für vier Jahre verlängert. Das gibt uns
die Chance, dieses ultimative Ziel zu erreichen.
Vielen Dank für das Gespräch.
Das Interview führte Ina Helms.
|


